Современная наука с каждым днем все ближе подходит к разгадке самых фундаментальных процессов жизни. Особое внимание специалистов всего мира приковывают генетические механизмы управления клеткой – основа как регенеративной медицины, так и онкологии. Стремительные успехи в области геномики, оцениваемые десятками миллиардов долларов инвестиций, свидетельствуют о высокой востребованности исследований в этой сфере. Лечебные стратегии будущего во многом будут зависеть от способности человека эффективно управлять генетической информацией и понимать законы работы ДНК и генов. В этом направлении ученые Пермского Политеха, в том числе Александр Никитюк, делают впечатляющие открытия, нацеленные на прорыв в борьбе с раком и изучении старения клеток.
Многообразие функций клеток: главный парадокс генетики
Несмотря на идентичность генетического материала в каждой клетке человеческого организма, они могут выполнять поразительно различные роли – становиться нейронами, мышечными или иммунными клетками. Долгое время ученые пытались описать этот феномен, изучая отдельные молекулярные элементы, например, белки, управляющие активацией генов, или химические сигналы, влияющие на запуск определенных процессов. Однако этого было недостаточно для понимания, как в клетке обеспечивается строгий порядок включения и выключения тысяч генов в определенные моменты жизни и развития.
Проблема синхронности: как тысячи генов действуют сообща
Биологи подробно исследовали, какие молекулярные механизмы лежат в основе активации отдельных генов – какие белки-активаторы, химические метки на ДНК. Эти знания оказались фундаментально важными, но постоянно возникал вопрос: что объединяет работу огромных комплексов генов, заставляя их изменять свое поведение с удивительной согласованностью? Ведь только слаженные перемены в активности большого числа генов могут обеспечить клетке переход из одного состояния в другое – например, из фазы деления в фазу старения или даже запускать программы клеточной трансформации, ведущие к возникновению опухолей.
Именно отсутствие понимания этого коллективного механизма ограничивает возможности создания эффективных методов диагностики и терапии сложных заболеваний, включая рак и нарушения развития. Без объяснения физических основ организованных изменений клеточного поведения многие терапевтические подходы остаются на уровне догадок.
Открытие ученых: физическое состояние ДНК как ключ к судьбе клетки
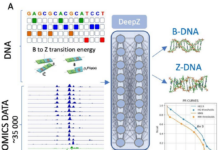
Команда Пермского Политеха во главе с Александром Никитюком впервые предложила объяснение, которое объединяет биологические и физические процессы управления клеткой. Они разработали математическую модель, показывающую, как конфигурация молекулы ДНК и ее физическое состояние определяют, активен тот или иной ген или "закрыт" для считывания.
Главная идея исследования состоит в следующем: для того чтобы определённый ген начал работать, его участок на длинной молекуле ДНК должен физически "открыться". Это значит – разорвать цепочку водородных связей и предоставить белкам-дочитывателям доступ к генетическому коду. Когда участок снова "закрывается", наследственная информация становится недоступной. Таким образом, судьба клетки определяется комбинацией открытых и закрытых состояний во множестве удалённых друг от друга генов по всей цепочке ДНК.
Управление судьбой клетки: новый взгляд на онкологию
Выяснилось, что "открытие" определённого участка ДНК — это не изолированное событие. Раньше биологи акцентировали внимание на химических модификациях и индивидуальных белках, но команда Пермского Политеха доказала: в основе коллективных изменений лежат физико-химические процессы самоорганизации самой структуры ДНК.
Когда меняется физическое состояние (например, происходит локальное расплетение спирали или изменение напряжения в цепочке), это способно оказывать эффект на сотни и тысячи других генов. Речь идет о своеобразной «волне», которая передается по молекуле и задаёт новую программу поведения для всей клетки – будь то переход в состояние старения, деления или даже запуск опухолевого роста.
Перспективы для лечения рака и продления молодости клеток
Открытие физических принципов управления генетическими программами клетки не только проливает свет на тайны развития жизни, но и дает мощный импульс для медицинских инноваций. По мнению Александра Никитюка и его коллег, понимание самоорганизации ДНК способно кардинально изменить подход к ранней диагностике и терапии онкологических заболеваний.
Нарушение синхронности работы генов – один из главных факторов, лежащих в основе развития рака. Поэтому теперь становится возможным создавать новые методы поиска и устранения сбоев в управлении ДНК ещё до появления первых симптомов болезни. Более того, управление физическим состоянием ДНК открывает перспективы для защиты клеток от преждевременного старения, что важно не только для предотвращения болезней, но и для общего продления активной жизни организма.
Оптимистичный взгляд в будущее: генетика как наука успеха
Работа ученых Пермского Политеха является значимым шагом к формированию принципиально новых инструментов борьбы с раком и другими сложными патологиями. Внутренние процессы, управляющие ДНК, становятся понятными и управляемыми, что наполняет исследование мощным прогностическим потенциалом. Понимание роли физического состояния ДНК уже сегодня позволяет ученым уверенно смотреть в будущее – во времена, когда болезни будут предотвращаться на уровне молекулярной архитектуры клетки, а процессы регенерации и омоложения станут обыденными для медицины нового поколения.
Таким образом, оптимистические перспективы, открывающиеся благодаря открытиям Александра Никитюка и его команды, вдохновляют не только научное сообщество, но и каждого, кто мечтает о здоровом и долголетнем будущем с минимальными рисками для здоровья.
Физические основы работы ДНК: новое понимание механизмов регуляции
Группа исследователей ПНИПУ предложила свежий взгляд на работу человеческой ДНК, акцентируя внимание на ее уникальных физических свойствах. По мнению ученых, ДНК — это не просто носитель наследственной информации, а биологический кристалл, в котором любое малейшее изменение отражается на всей структуре. Если в одной точке молекулы возникает локальное напряжение, то оно способно распространиться по цепочке и тем самым физически воздействовать на соседние гены. Это открывает новые горизонты понимания того, как гены «включаются» и «выключаются» по скоординированному сценарию.
В отличие от традиционного подхода, где генетики анализируют отдельные фрагменты ДНК, специалисты ПНИПУ начали рассматривать молекулу как целостную систему. Эта методика позволяет увидеть, как изменения в одном участке способны оказывать влияние на всю геномную цепь, создавая условия для единой, сложной и гармоничной работы генетического механизма.
Гипотеза о глобальной координации генов
В основу нового подхода легла гипотеза о физической взаимосвязи между участками ДНК. Этот феномен исследователи сравнивают с волной: напряжение, возникшее в одном месте, передается по всей молекуле, синхронизируя работу тысяч генов. Именно эта волновая динамика, по предположению ученых, объясняет слаженность и эффективность деятельности ДНК.
Чтобы проверить данную гипотезу, команда ПНИПУ разработала математическую модель, позволяющую рассматривать всю молекулу ДНК в качестве единого объекта. Согласно их предположениям, каждый участок ДНК может находиться в одном из трех основных состояний — стабильном, неустойчивом или критическом. Подобные наблюдения уже встречались ранее в биологических экспериментах, однако теперь они получили физико-математическое обоснование, позволяющее интерпретировать их в новом свете.
Описание трех состояний участков ДНК
Как пояснил Александр Никитюк, доцент кафедры математического моделирования систем и процессов ПНИПУ, одним из важных этапов исследования стало введение трех ключевых режимов, в которых может пребывать генетический участок:
- Стабильное состояние — участок «закрыт», изменения невозможны.
- Неустойчивое состояние — фрагмент готов к переходу после незначительного сигнала.
- Критическое состояние — участок полностью раскрывается и способен запустить цепную реакцию, влияющую на активность всей молекулы.
Каждое из описанных состояний играет определяющую роль в жизненном цикле клеток и формировании их функциональной грамотности. Структурный параметр, введенный в модель, позволил отследить, как именно переход между этими состояниями определяет «судьбу» клеточных участков и, как следствие, всей клетки.
Волновой эффект: кооперативные изменения в геноме
Результаты моделирования оказались обнадеживающими: если отдельные участки ДНК начинают «открываться», то вся молекула начинает стимулировать аналогичные изменения в соседних зонах. Таким образом, в пределах всего генома запускается волна согласованных изменений, напоминая цепную реакцию. Такой кооперативный режим объясняет способность клетки одновременно и быстро управлять активностью множества генов — например, в процессе деления или формирования специализированных функций.
Дальнейшее сравнение предсказаний модели с реальными экспериментальными данными на различных типах клеток — от эмбриональных до опухолевых — показало впечатляющее совпадение статистических выводов. Это подтверждает универсальность предложенного механизма и его ключевое значение для регуляции человеческого генома.
Открытие природы онкологических процессов
Одним из наиболее значимых результатов этого исследования стало физико-математическое объяснение природы онкологических заболеваний. Согласно разработанной модели, раковая клетка — это клетка, которая задержалась в стадии деления из-за недостаточного количества открытых или критических участков в структуре молекулы ДНК. Такое состояние препятствует нормальному развитию клетки и мешает переключению ее судьбы.
В отличие от злокачественных клеток, нормальные клетки обладают множеством участков, способных быстро переходить из одного состояния в другое, что обеспечивает слаженную «каскадную» смену функциональных режимов. Это явление исследователи ПНИПУ назвали «каскадом критичности». При онкопроцессах каскад нарушается, что подчеркивает: новый подход открывает уникальные возможности для разработки инновационных терапевтических стратегий. Цель теперь не просто уничтожить патологические клетки, а попытаться изменить их внутренние процессы, подталкивая их к завершению цикла развития либо к запрограммированной гибели.
Потенциал для медицины будущего
Выводы, сделанные учеными, открывают перспективы и для регенеративной медицины, и для генной терапии. Глубокое понимание процессов переключения состояний молекул ДНК позволяет не только точнее перепрограммировать клетки для достижения лечебного эффекта, но и повысить безопасность подобных процедур. Такой подход вселяет оптимизм относительно возможностей борьбы с тяжелыми заболеваниями и продления активного долголетия.
Итак, комплексное исследование, проведенное ПНИПУ, не просто приближает нас к разгадке загадок генетики, но и показывает, насколько важно видеть живые системы глазами физика, ощущая их как динамические, самоорганизующиеся структуры. Эта точка зрения позволяет не только объяснить фундаментальные законы биологии, но и строить эффективные стратегии по восстановлению и поддержанию здоровья человека в будущем.
Ученые выяснили, что важнейшие процессы, лежащие в основе жизни, такие как выбор клеткой дальнейшего пути своего развития, подчиняются определенным универсальным законам природы. Причем эти закономерности удается выразить в конкретных количественных моделях. Такой подход открывает новые горизонты для понимания основ биологических процессов.
Перспективы исследовательских открытий
На сегодняшний день одной из наиболее интересных задач остается поиск эффективных методов для точного определения структурных параметров прямо внутри живых клеток. Решение этой задачи станет основой для прямого тестирования существующих теоретических моделей и значимо ускорит продвижение в области клеточной биологии. Такие методы позволят не просто подтвердить справедливость законов, но и вывести процесс изучения природы клетки на совершенно новый уровень сложности и точности.
Успешная разработка таких методик откроет колоссальные возможности. Уже в ближайшем будущем это позволит внедрять полученные научные знания в медицинскую практику — и создавать более эффективные методы ранней диагностики заболеваний, разрабатывать новые биотехнологические решения. Более глубокое понимание закономерностей жизни на клеточном уровне непременно приведет к улучшению качества жизни, а также к появлению инновационных медицинских технологий.
Будущее биомедицины и биотехнологий
Современные исследования демонстрируют, что количественный подход к анализу поведения клеток способен не только объяснить фундаментальные биологические явления, но и стимулировать создание уникальных терапевтических методов. В дальнейшем применение полученных данных обещает революционизировать медицину и биоинженерию. Появится возможность влиять на биологические решения клеток, управлять их развитием и даже предупреждать развитие патологий на самых ранних этапах.
Безусловно, эти открытия означают новый этап в развитии науки: благодаря поиску универсальных законов клетки становятся объектом точной науки, а не только предметом наблюдения. Прогресс на этом пути будет способствовать ускорению создания инновационных лекарств, высокоточных диагностических средств и новых способов профилактики заболеваний, что открывает оптимистичные перспективы для всего человечества.
Источник: naked-science.ru